(Deák Veronika
'után')
|
APOPTÓZIS – programozott
sejthalál DNS-REPAIR – hibajavító mechanizmusok TELOMER/TELOMERÁZ ...és a RÁK |
a DNS gyakran sérül
|
|
|
|
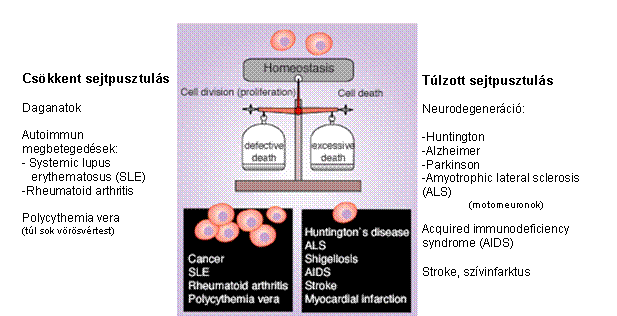
a sejtosztódás és a sejpusztulás
szabályozása fontos
ember: ~1015 sejtjéből naponta ~1011 elhal és új sejtekkel cserélődik le
(intenzív pl. csontvelőben,
bélhámokban)
A sejtkeletkezési/elhalási egyensúly
megbomlása: súlyos betegségek
|
|
|
|
|
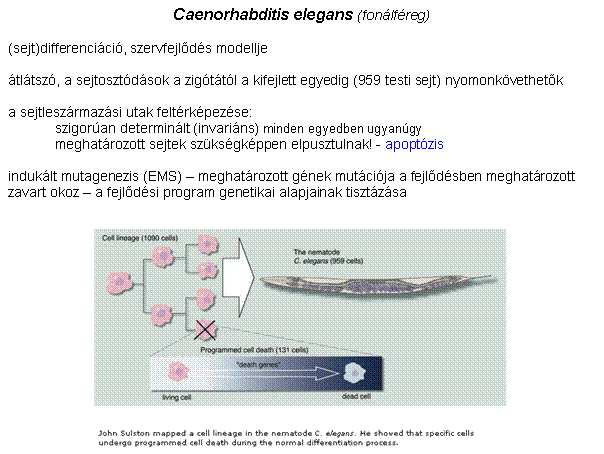
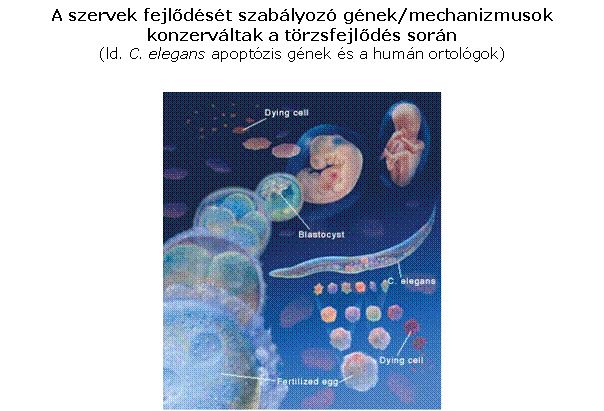
A szervfejlődés és a programozott sejthalál
genetikai szabályozásának leírása
|
|
|
|
|
|
|
|
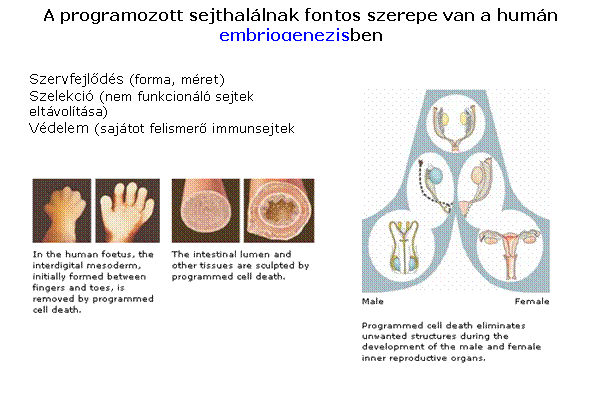
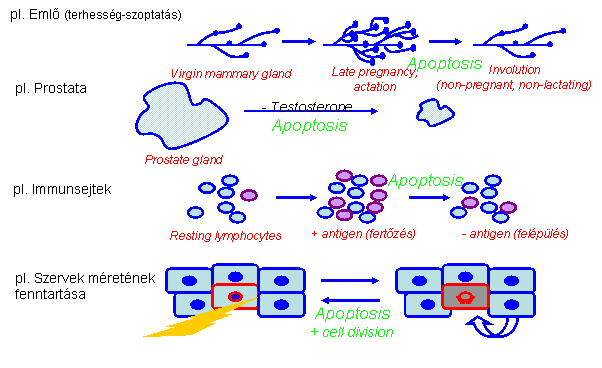
az apoptózisnak fontos szerepe van a felnőtt
emberi szervezetben Szövet 'remodeling' – a funkcióját
vesztett/károsodott sejtek eltávolítása
|
|
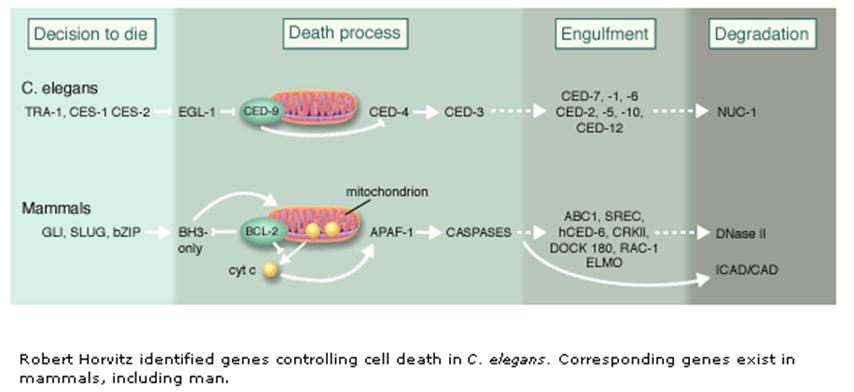
A programozott sejthalál mechanizmusa és a részt
vevő gének/fehérjék evolúciósan konzerváltak
|
|
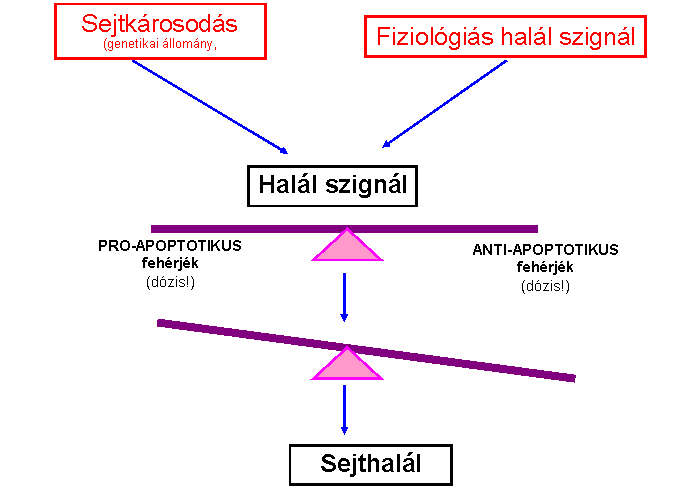
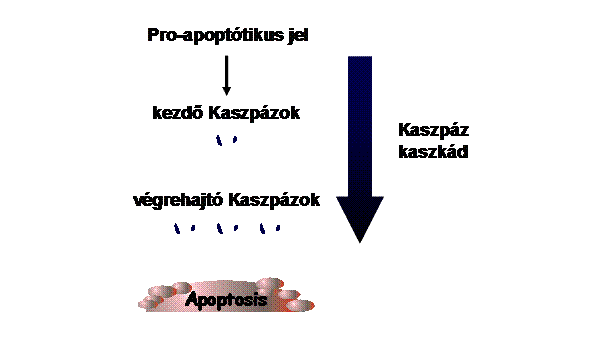
Az apoptózis fő „játékosai” kaszpázok (caspases) - az apotózis végrehajtói -
aktív helyükön ciszteint tartalmazó,
aszparaginsav mellett hasító
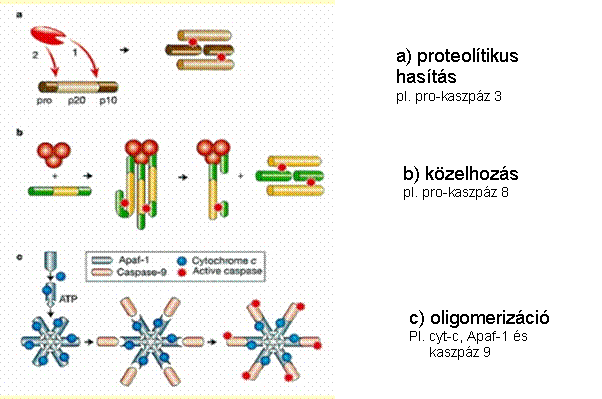
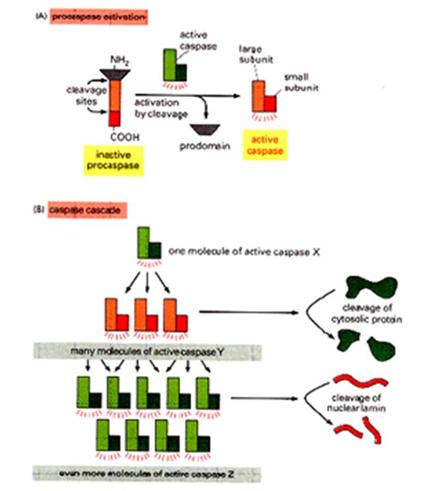
proteázok - kaszpáz kaszkád: pro-kaszpázok aktivációja más kaszpázok
által - iniciátor és effektor kaszpázok - aktív enzim: dimer vagy tetramer 'Mindent vagy semmit' folyamat - végigmegy halál
szignál/receptor (TNF/TNFR) p53 (apoptózis serkentés) BAX (apoptózis
serkentés) Bcl-2
fehérjecsalád (apoptózis gátlás) proapoptotikus (serkentő) és antiapoptotikus (gátló) gének/fehérjék bax bcl-2 bad bcl-x bcl-xs mcl-1 myc bcl-w p53 (homo- és heterodimer
formák) p73 virális
gének EBV
(Epstein-Barr vírus) BHRF-1, adenovírus E1B19K |
|
|
|
Az
apoptózis 'madártávlatból'
|
|
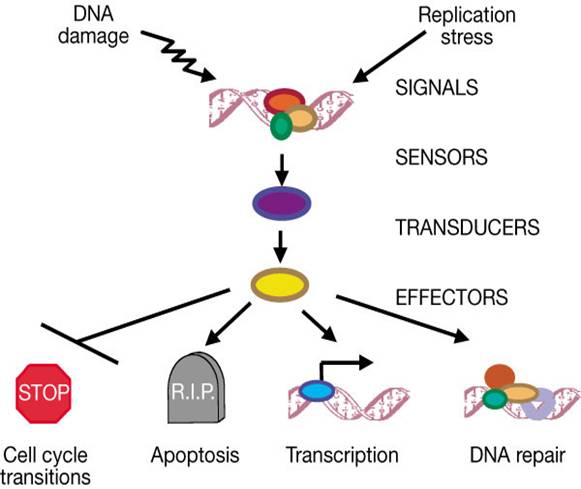
A DNS-károsodásra adott
sejtválasz kulcselemei
|
|
|
|
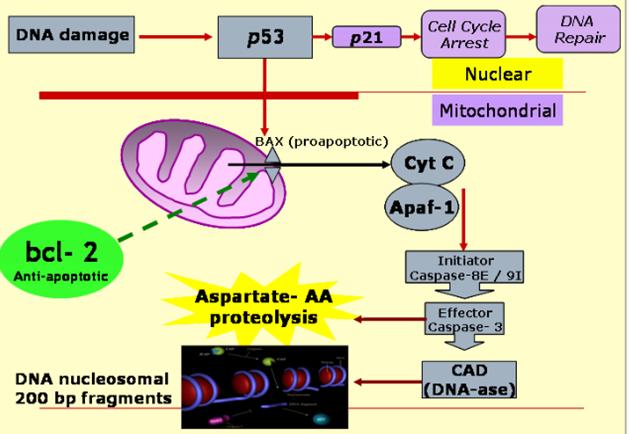
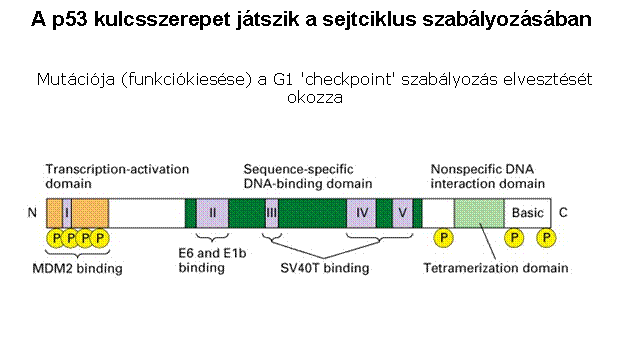
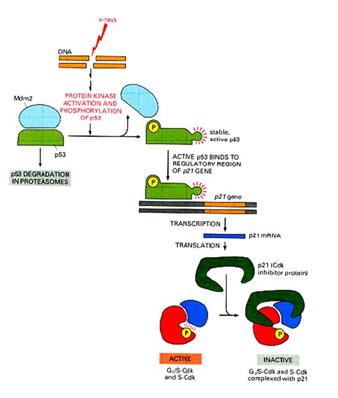
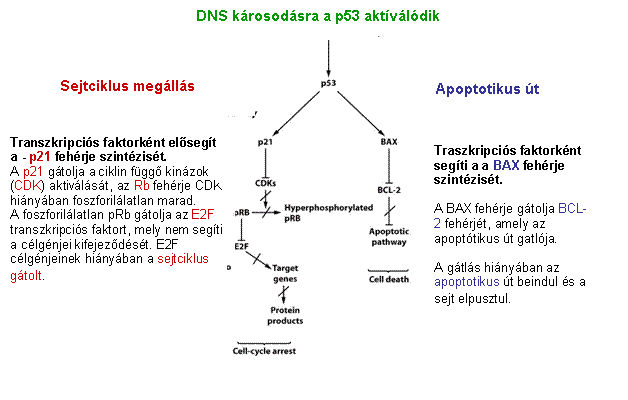
p53 aktiváció: a sejtciklus
megállítása a G1/S-ben Normál
sejtben p53 instabil és alacsony koncentrációban van jelen mert az Mdm2
lebontásra jelöli ki. DNS
károsodás hatására olyan protein kinázok aktiválódnak, (ATM: ataxia telangiectasia és ATR: ATM-related) amelyek p53-t foszforilálják, ez
csökkenti affinitását az Mdm2-höz, stabilizálódik, az
aktív p53 géneket aktivál (sejtciklust felfüggesztő gének, repair gének,
apoptózist indukáló gének, Mdm2, stb.) |
|
|
A p53 szerepe a DNS károsodásra
adott válaszban
|
|
A kaszpáz-aktiválás
mechanizmusai:
|
|
Kaszpáz kaszkád – mindent vagy semmit
|
|
programozott
sejthalál (apoptózis) és a daganatképződés Ha a sejt nem képes az apoptózisra (köszönhetően mutációknak, vagy egyéb biológiai gátlásnak),
akkor korlátlan szaporodásnak indulhat és tumort képezhet A sejthalál fontos feladatot lát el a daganatképződés
megakadályozásában |
|
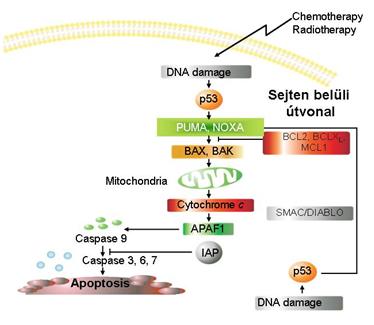
A daganatkialakulás kivédésének egyik módja a
hibás sejtek eltávolítása: apoptózissal A kemo- és a sugárterápiával a programozott
sejthalál beindítását célozzák meg a sejten belüli apotótikus út
aktiválásával, a p53-as útvonalon keresztül |
|
|
REPAIR – a DNS hibáit
javító mechanizmusok
|
|
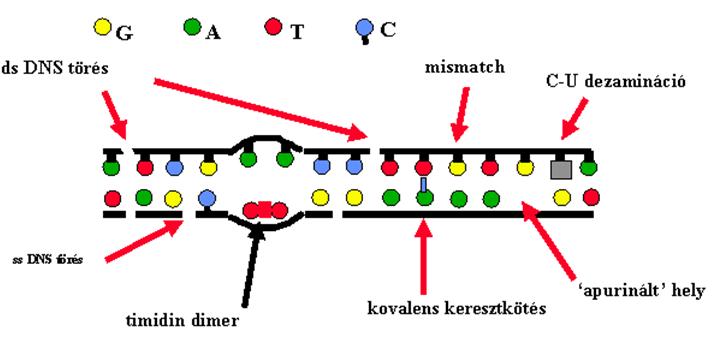
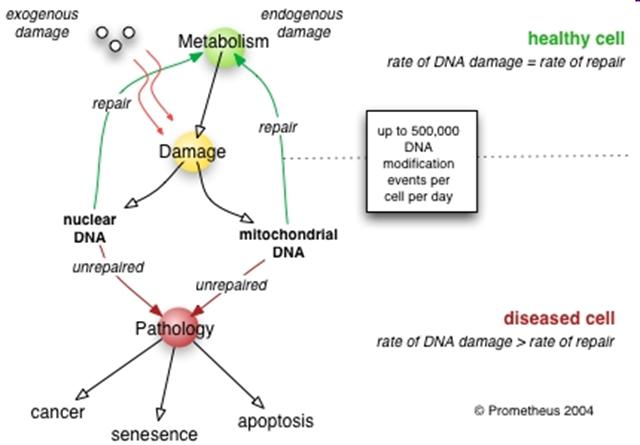
A DNS károsodások
zöme javításra kerül
|
DNS Repair
|
Fő lépések: •
a hiba érzékelése/hibajelzés •
a javító mechanizmusok aktiválása •
a DNS re-szintézise (polimeráz) •
a DNS szálak folytonosságának kialakítása (ligáz) |
|
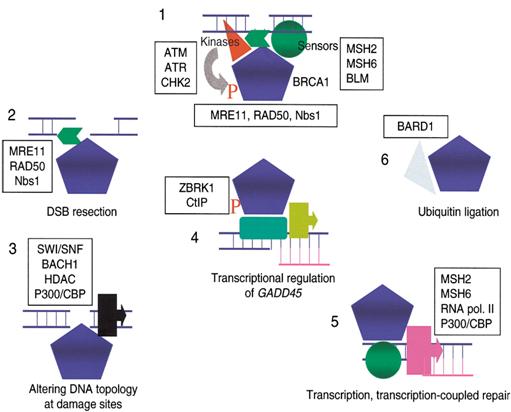
A DNS hibákat érzékelő/jelző molekulák
|
|
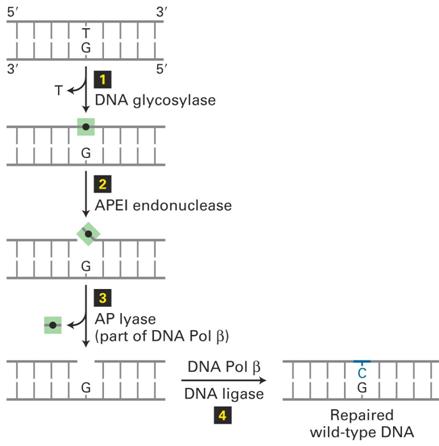
Bázis Excíziós Repair (BER)
|
|
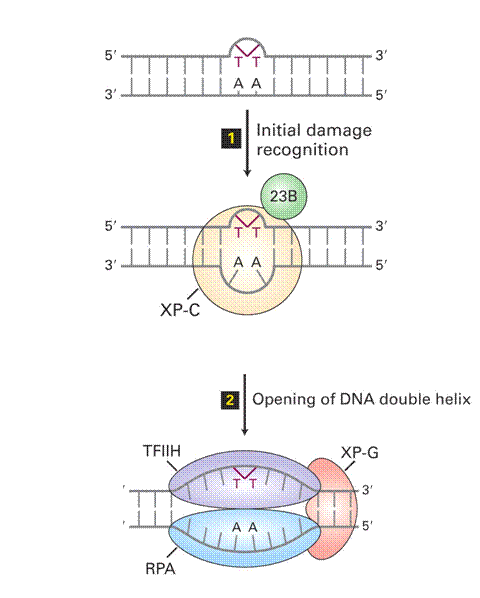
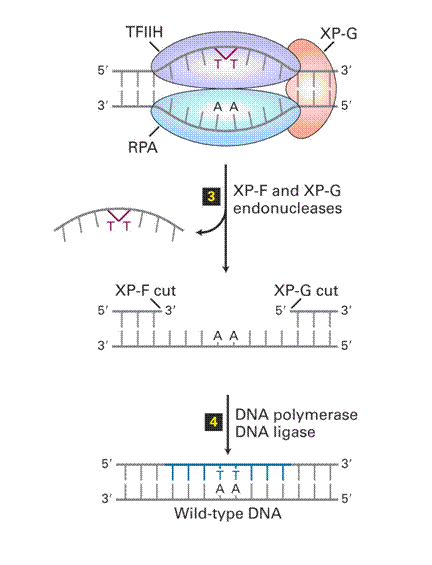
Nukleotid Excíziós Repair (NER) 1.
|
|
|
|
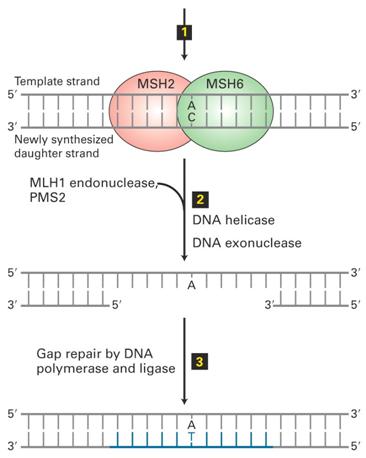
Mismatch Repair (MMR)
|
|
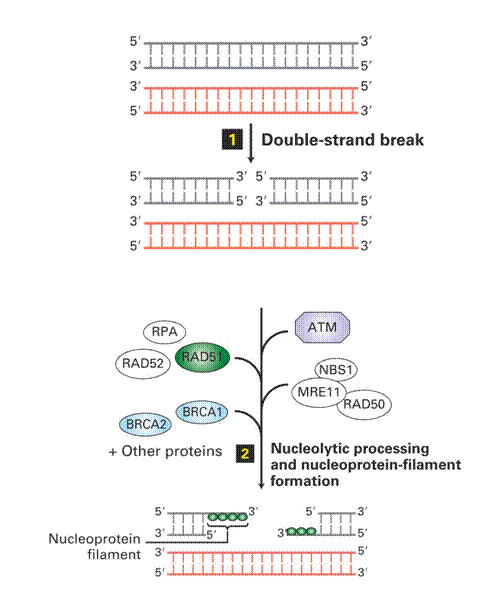
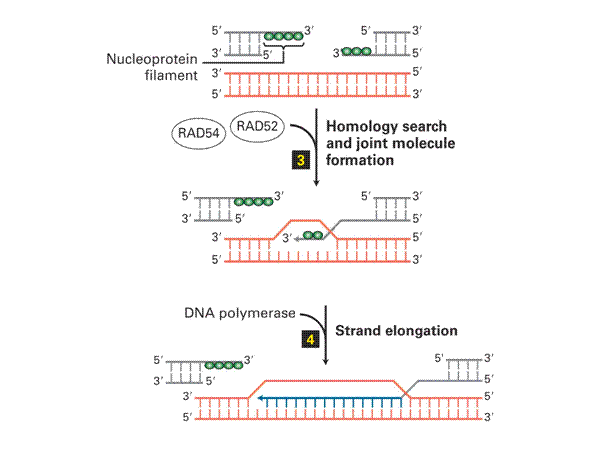
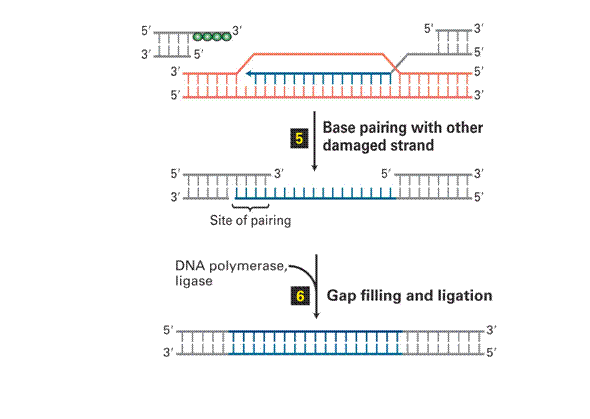
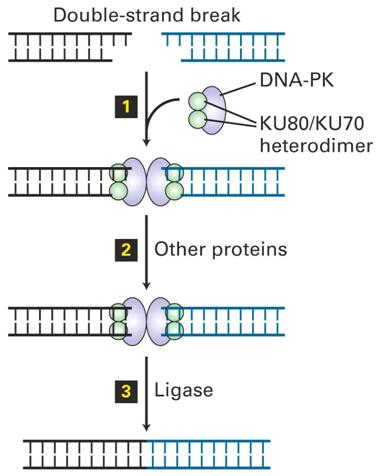
Homologous Recombination és End Joining Repair 1.
|
|
|
|
|
|
Dupla szálú törés
|
|
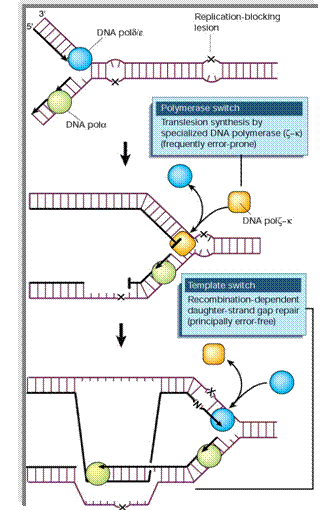
Translesion DNA synthesis és Replicative Bypass and Recombination
|
|
A DNS hibajavítás és
a daganatképződés kapcsolata DNS repair gének: -
mutációik a repairben részt
vevő fehérjék funkciókiesését okozza -
különböznek a
tumor-szupresszor génektől: tumor-szupresszor
gén – direkt módon, befolyásolja
a növekedést (sejtosztódást) és differenciációt A DNS repair gének inaktivációja
más gének megemelkedett
mutációs rátájához vezet többek között: proto-onkogének,
tumor-szupresszor gének – tumor progresszió A normál repair mechanizmusok
károsodása és egyúttal a sejt
„kibújása” az apoptózis alól, elvezethet daganatsejt képződéséhez |
|
A DNS repair
gének hibája a mutációk felhalmozódásához vezet és az egyes gének mutációi
meghatározott daganat típusok kialakulásával kapcsolt
|
Absence of the DNA
repair enzyme human 8-oxoguanine glycosylase is associated with an aggressive
breast cancer phenotype
Loss of expression
of DNA repair enzymes MGMT, hMLH1, and hMSH2 during tumor progression in
gastric cancer
Methylation of the hMLH1
Promoter Correlates with Lack of Expression of hMLH1 in Sporadic Colon Tumors
and Mismatch Repair-defective Human Tumor Cell Lines
repair
vonatkozású betegségek
|
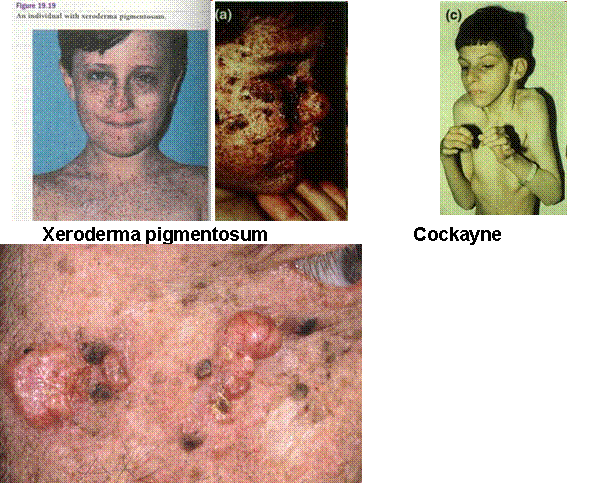
ATM (="ataxia telangiectasia mutated") - kettős DNS-törés érzékelése/jelzése - ezáltal a sejtciklus leállítása (p53-on keresztül) - normális telomerhossz fenntartása Cockayne
syndrome (Edward Alfred Cockayne
brit orvos után) Trichothiodystrophy
(kénhiányos haj, hámlás-zavar) Werner
syndrome – Progéria (WRN gén – helikáz mutációja, telomervesztés is
gyorsabb) Hereditary non
polyposis colon cancer (HNPCC) Xeroderma
pigmentosum (XP) (Nucleotide
excíziós repair, több fehérje) Bloom’s
syndrome Fanconi
Anaemia (Fanc... min. 13 gén
valamelyikének hibája) |
|
|
|
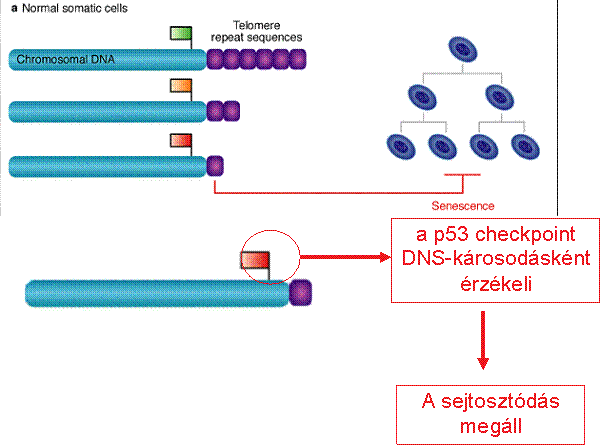
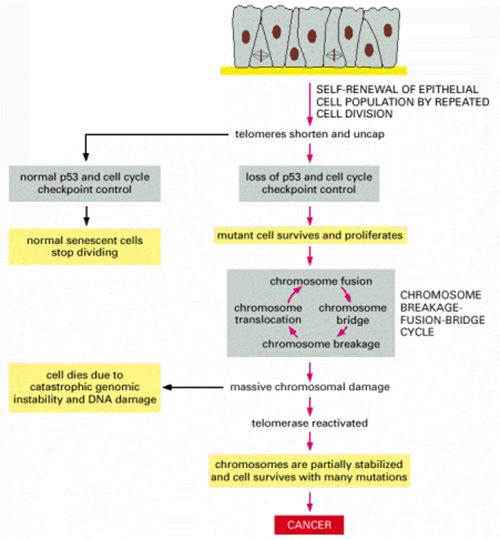
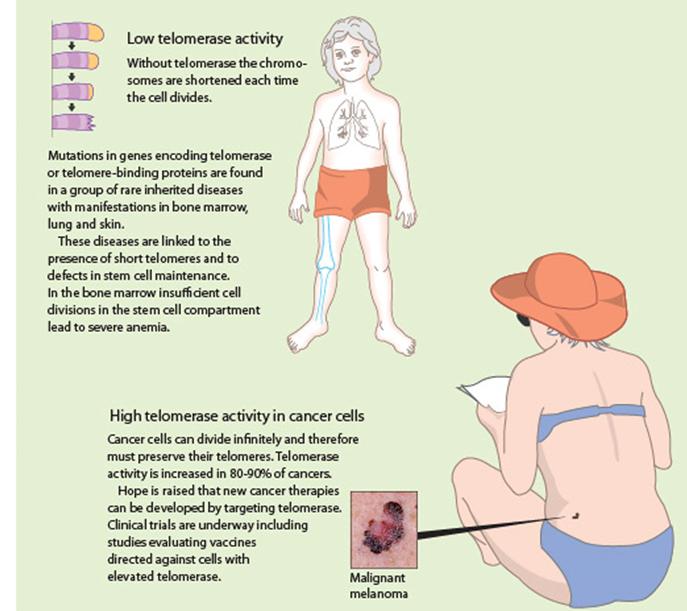
Telomerek és a
daganatkeletkezés A daganatsejtek korlátlan számú
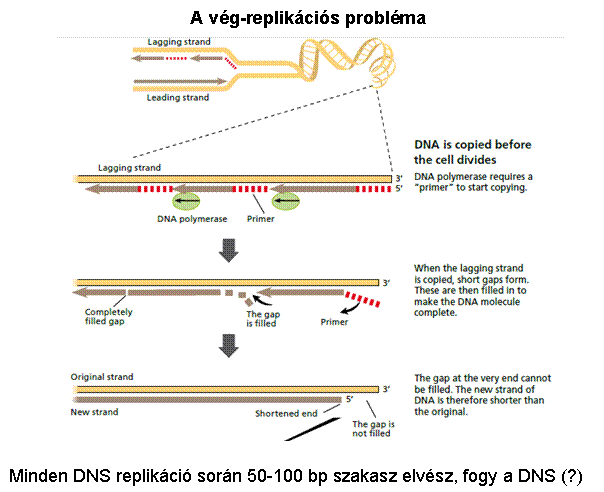
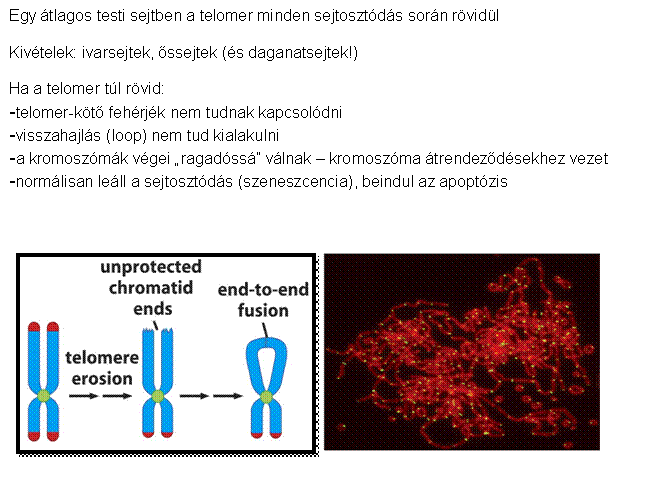
osztódásra képesek Egy normális sejt 60-70 osztódásra
képes (Hayflick limit) (kromoszóma végéről egy szakasz
minden osztódás során elvész) A genetikailag nem stabil sejt
normális esetben elpusztul A daganatsejtek nem pusztulnak
el, tovább osztódnak és egyre több hibát halmoznak fel - képesek “halhatatlanná” tenni
magukat pl. a HeLa sejtvonal (Henrietta Lacks, 1951-ben izolálták) |
|
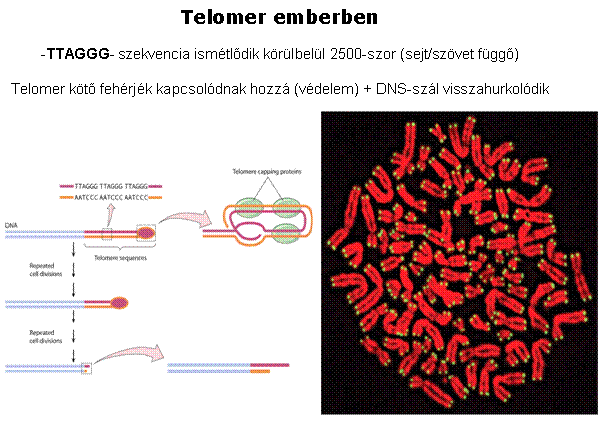
A kromoszómák végeit a telomerek védik, aminek
fenntartását a telomeráz enzim végzi
|
|
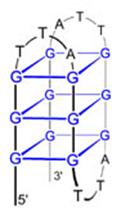
A telomer sapkaként védi a kromoszómák végeit Görög: telos (vég) + meros (rész)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
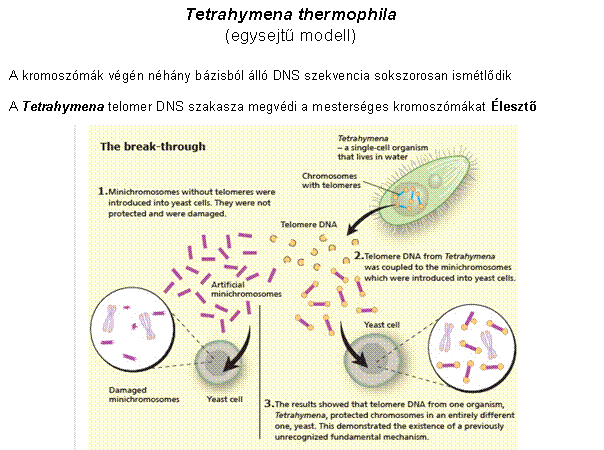
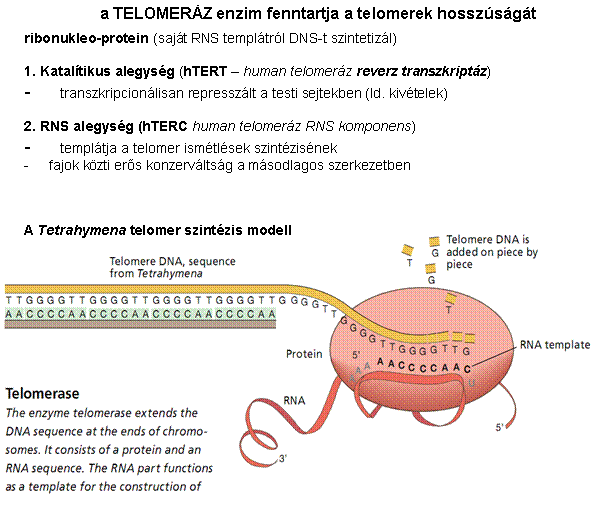
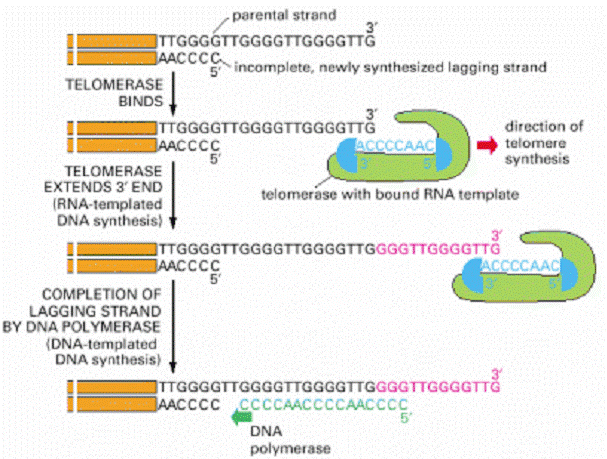
A telomer szintézisét a
TELOMERÁZ enzim végzi
|
|
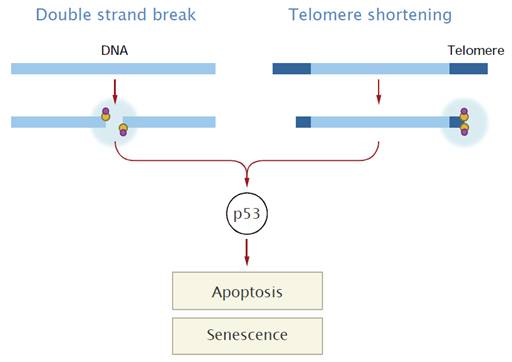
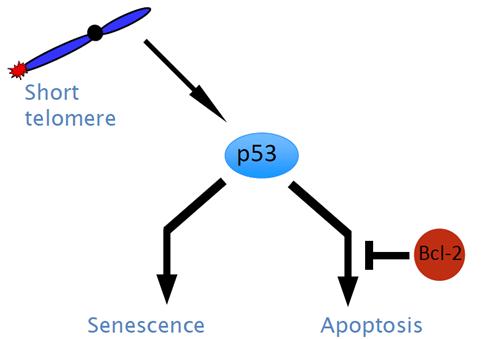
A szeneszcencia és apoptózis
védelmi szerepet tölt be a tumorképződés szempontjából
|
|
|
|
|
|
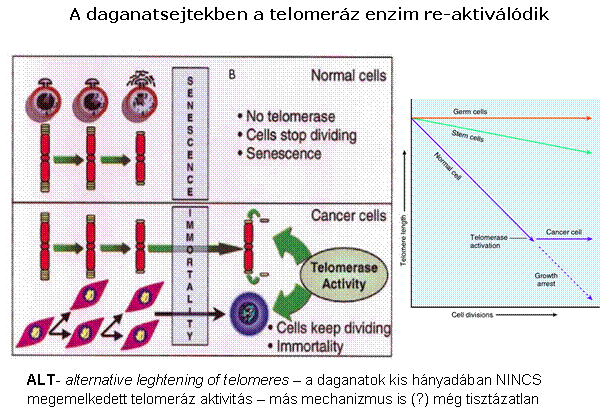
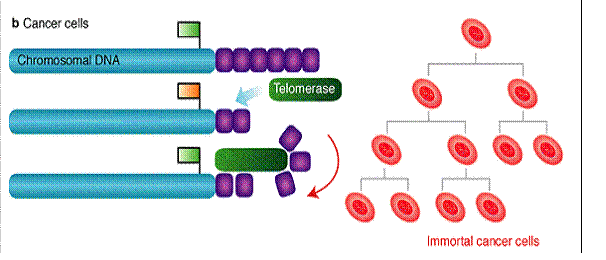
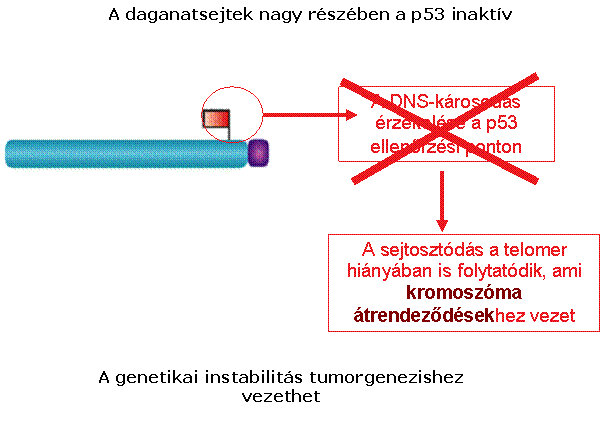
A telomeráz aktivitás a daganatsejtekben fenntartja
a telomerek hosszát, így az nem szab gátat a határtalan sejtosztódásnak
|
|
|
|
Telomerek és
dagatkialakulás
|
|
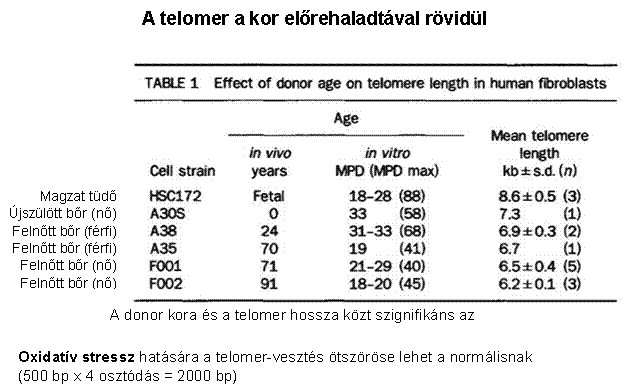
A telomereknek fontos szerepük van a rák, az öregedés
és néhány örökletes betegség kialakulásában
|
|
|