(Deák Veronika
'után')
|
APOPTÓZIS – programozott
sejthalál DNS-REPAIR – hibajavító mechanizmusok TELOMER/TELOMERÁZ ...és a RÁK |
a DNS gyakran sérül
|
|
|
|
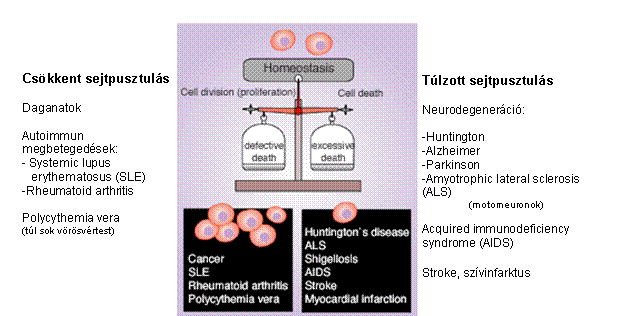
a sejtosztódás és a sejpusztulás
szabályozása fontos
ember: ~1015 sejtjéből naponta ~1011 elhal és új sejtekkel cserélődik le
(intenzív pl. csontvelőben,
bélhámokban)
(sejtkeletkezési/elhalási egyensúly megbomlása: súlyos
betegségek)
|
|
Nekrózis: sejt pusztulás pl. sérülést követően, a membrán károsodik,
a
citoplazma 'kiömlik' - immunválasz - kisebb nagyobb gyulladásos folyamat
APOPTÓZIS -
programozott sejthalál
(görög: apopto
szisz=falevelek hullása)
a sejt összehúzódik,
a DNS fragmentálódik, a sejtmag
felbomlik,
a citoszkeleton
felbomlik - membránnak határolt fragmentumok - nincs gyulladásos folyamat,
a sejtfelszinen
markerek jelennek meg, amelyek a sejt fagocitálását segítik
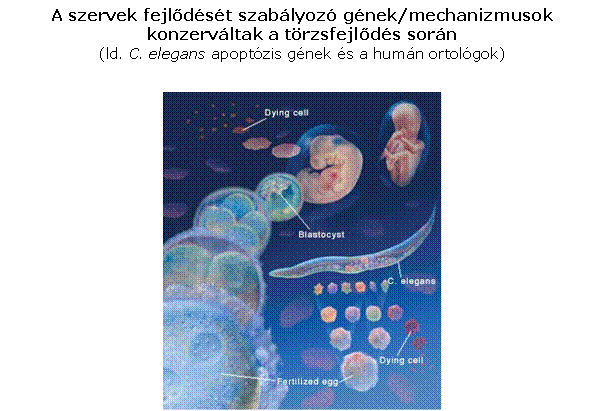
- meghatározott sejtek/sejtcsoportok
meghatározott eltűnése térben/időben
- a jelenség az embriogenezis és
metamorfózis része
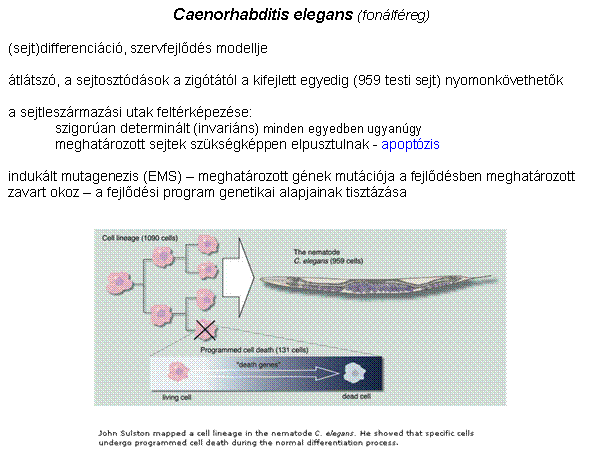
(Caenorhabditis
elegans fonálféreg – modellállat - az elhalási program genetikai
alapjainak leírása)
|
A szervfejlődés és a programozott sejthalál
genetikai szabályozásának leírása
|
|
|
|
|
|
|
|
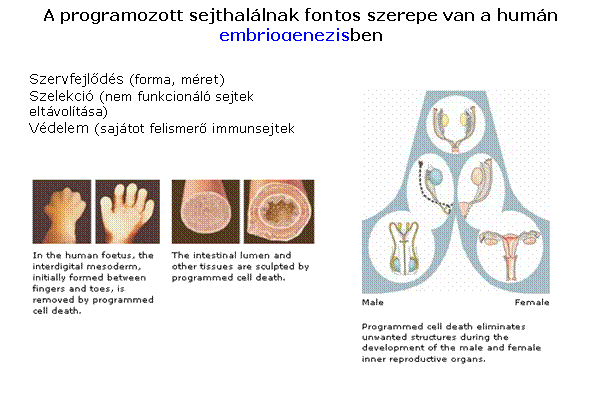
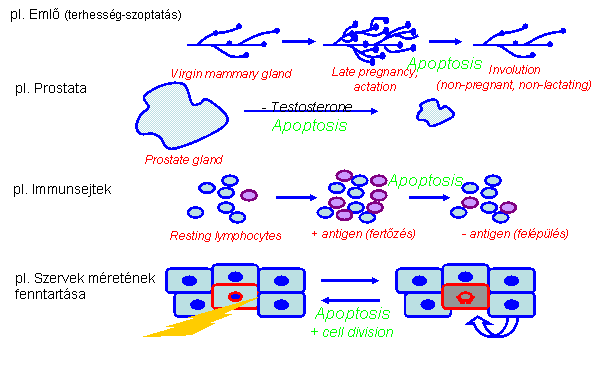
az apoptózisnak fontos szerepe van a felnőtt
emberi szervezetben is Szövet 'remodeling' – a funkcióját
vesztett/károsodott sejtek eltávolítása
|
|
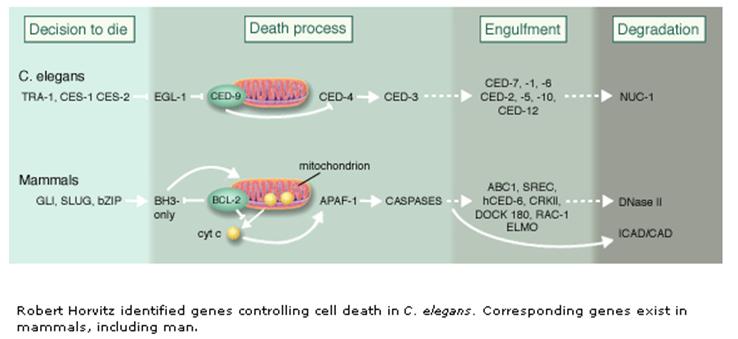
A programozott sejthalál mechanizmusa és génjei/fehérjéi
az evolúció során konzerváltak
|
|
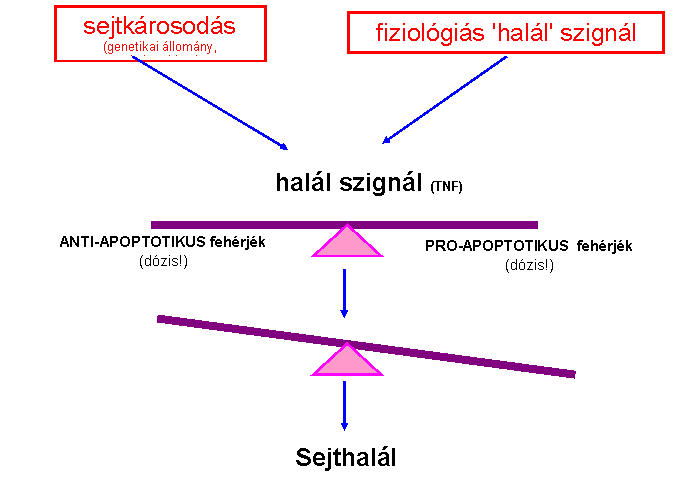
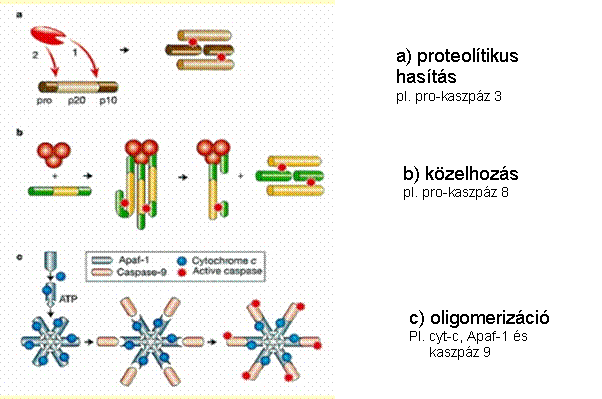
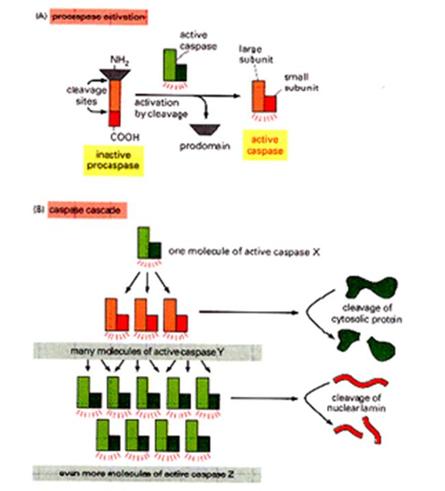
Az apoptózis fő „játékosai” kaszpázok
(caspases) - az apotózis végrehajtói -
aktív helyükön ciszteint tartalmazó,
aszparaginsav mellett hasító proteázok - kaszpáz kaszkád: pro-kaszpázok aktivációja más kaszpázok
által - iniciátor és effektor kaszpázok - aktív enzim: dimer vagy tetramer 'Mindent vagy semmit' folyamat - végigmegy halál
szignál/receptor (TNF/TNFR) p53 (apoptózis serkentés) BAX (apoptózis
serkentés) Bcl-2
fehérjecsalád (apoptózis gátlás) proapoptotikus (serkentő) és antiapoptotikus (gátló) gének/fehérjék bax bcl-2 bad bcl-x bcl-xs mcl-1 myc bcl-w p53 (homo- és heterodimer
formák) p73 virális
gének EBV
(Epstein-Barr vírus) BHRF-1, adenovírus E1B19K |
|
|
|
|
|
|
|
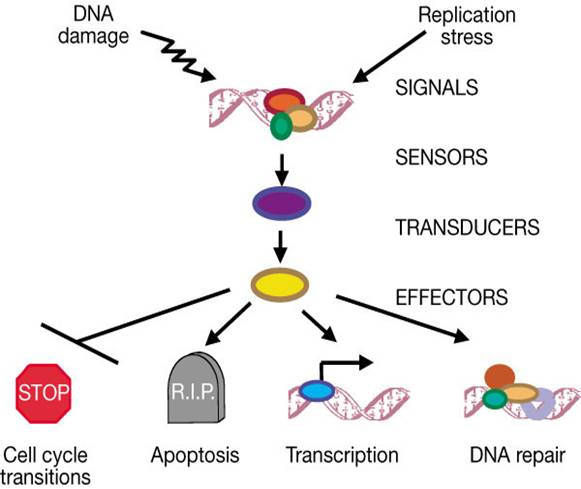
A DNS-károsodásra adott
sejtválasz kulcselemei
|
|
|
|
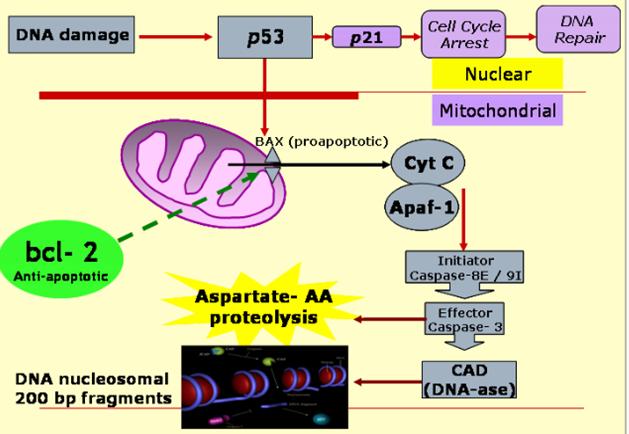
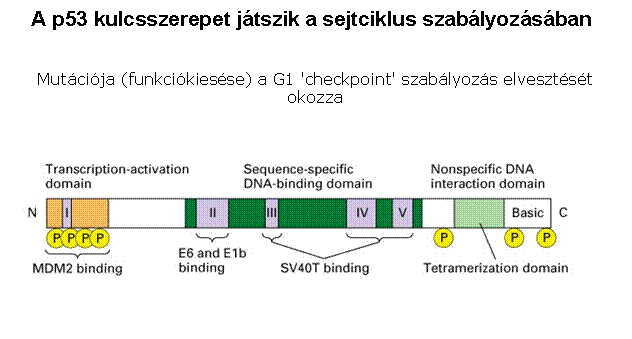
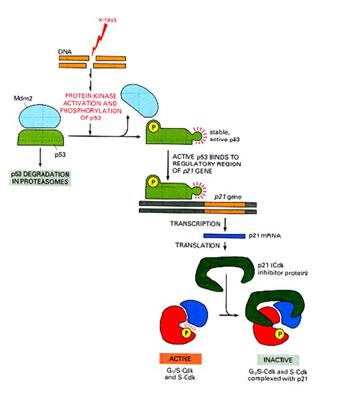
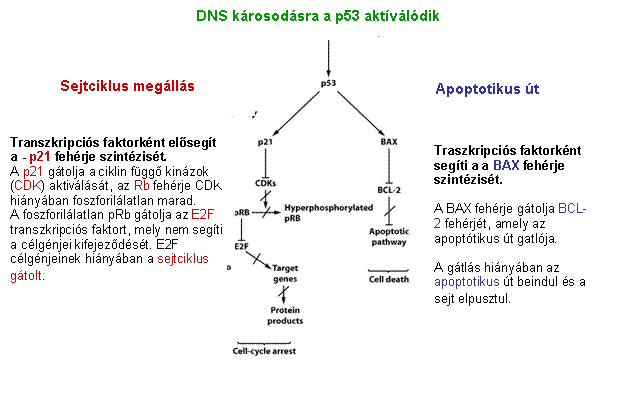
p53 aktiváció: a sejtciklus
megállítása a G1/S-ben Normál
sejtben p53 instabil, alacsony koncentrációban van jelen mert az Mdm2 ubiquitinizálja
DNS
károsodás hatására olyan protein kinázok aktiválódnak, (ATM: ataxia telangiectasia
és ATR: ATM-related) amelyek p53-t foszforilálják, ez
csökkenti affinitását az Mdm2-höz, stabilizálódik, az
aktív p53 gének átírását aktiválja (sejtciklust felfüggesztő gének, repair gének,
apoptózist indukáló gének, Mdm2, stb.) |
|
|
A p53 szerepe a DNS károsodásra
adott válaszban
|
|
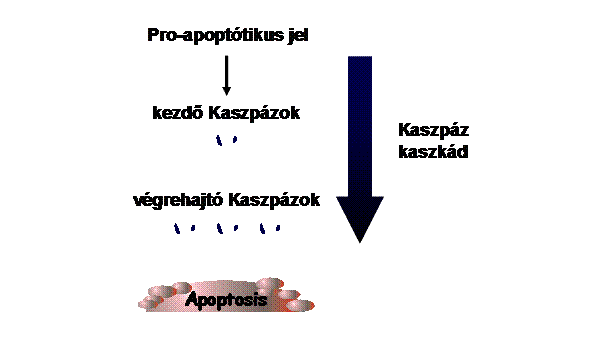
A kaszpáz-aktiválás
mechanizmusai:
|
|
Kaszpáz kaszkád – mindent vagy semmit
|
|
programozott sejthalál
(apoptózis) és a daganatképződés Ha a sejt nem képes az apoptózisra (köszönhetően mutációknak, vagy egyéb biológiai gátlásnak),
akkor korlátlan szaporodásnak indulhat és tumort képezhet A sejthalál fontos feladatot lát el a daganatképződés
megakadályozásában |
|
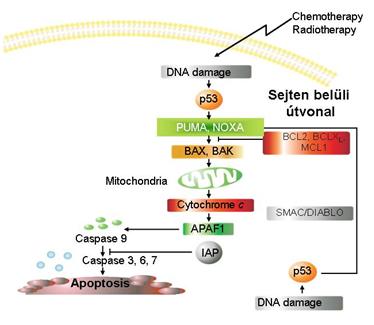
A daganatkialakulás kivédésének egyik módja a
hibás sejtek eltávolítása: apoptózissal A kemo- és a sugárterápiával a programozott
sejthalál beindítását célozzák meg a sejten belüli apotótikus út aktiválásával,
a p53-as útvonalon keresztül |
|
|
REPAIR – a DNS hibáit
javító mechanizmusok
|
|
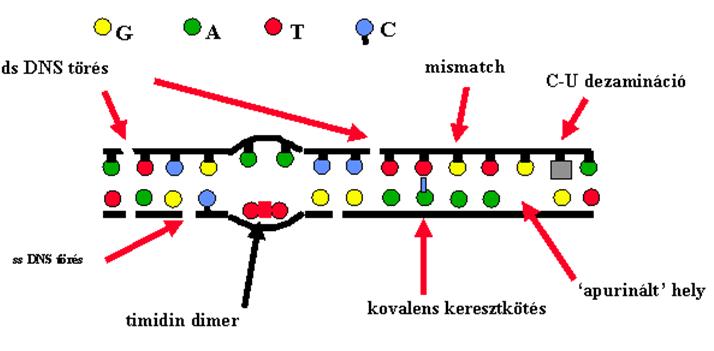
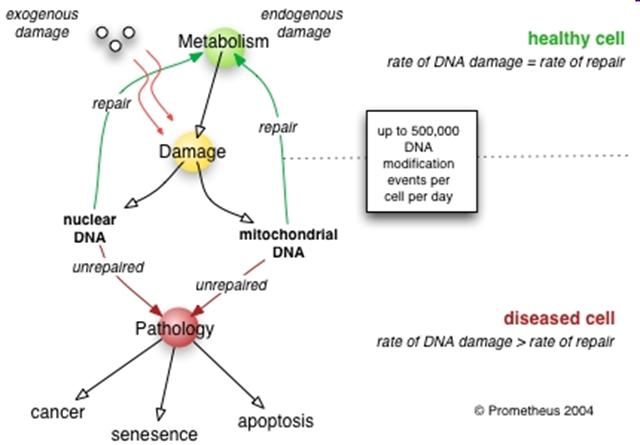
A DNS károsodások
zöme javításra kerül
|
Mekkora probléma??
körülbelül 1,000,000,000,000,000,000 (1018)
DNS sérülés minden felnőtt emberben naponta!
kb. 300.000.000.000 (3x1011) sejtünk van
. . . (~3x106/nap/sejt)
A LEGTÖBB MUTÁCIÓ SPONTÁN,
DE KÉMIAI ANYAGOKKAL (mutagének) INDUKÁLNI IS LEHET MUTÁCIÓT –
nő a mutációs frekvencia
DNS Repair
|
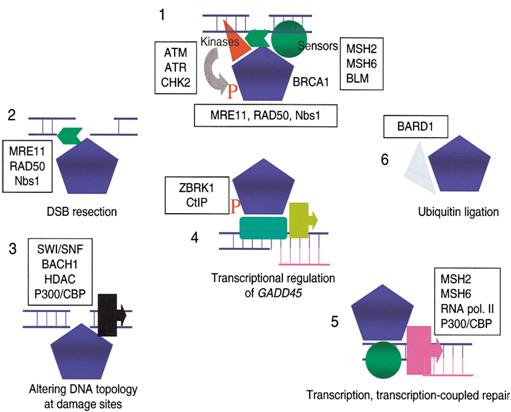
Fő lépések: •
a hiba érzékelése/hibajelzés •
a javító mechanizmusok aktiválása •
a DNS re-szintézise (polimeráz) •
a DNS szálak folytonosságának kialakítása (ligáz) |
|
A DNS hibákat érzékelő/jelző molekulák
|
különböző mechanizmusokkal javítja a hibákat a repair rendszer
|
a DNS hibajavítás és a
daganatképződés kapcsolata DNS repair gének: -
mutációik a repairben részt
vevő fehérjék funkciókiesését okozza -
különböznek a
tumor-szupresszor génektől: tumor-szupresszor
gén – direkt módon, befolyásolja
a növekedést (sejtosztódást) és differenciációt DNS repair gén –
közvetett (indirekt) módon A DNS repair gének inaktivációja
más gének megemelkedett
mutációs rátájához vezet többek között: proto-onkogének,
tumor-szupresszor gének – tumor progresszió A normál repair mechanizmusok
károsodása és egyúttal a sejt
„kibújása” az apoptózis alól, elvezethet daganatsejt képződéséhez |
|
A DNS
repair gének hibája - a
mutációk felhalmozódásához vezet és - az
egyes gének mutációi meghatározott daganat típusok kialakulásával kapcsolt
|
Absence of the DNA repair enzyme human 8-oxoguanine glycosylase is
associated with an aggressive breast cancer phenotype
Loss of expression of DNA repair enzymes MGMT, hMLH1, and hMSH2 during
tumor progression in gastric cancer
Methylation of the hMLH1 Promoter Correlates with Lack of
Expression of hMLH1 in Sporadic Colon Tumors and Mismatch Repair-defective
Human Tumor Cell Lines
repair
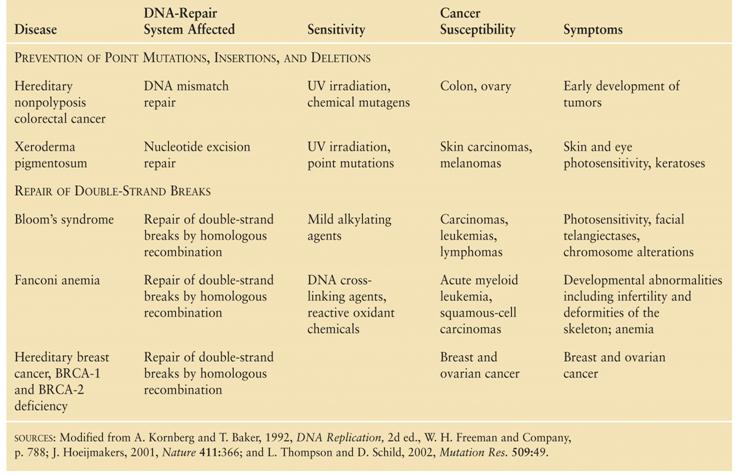
vonatkozású betegségek
|
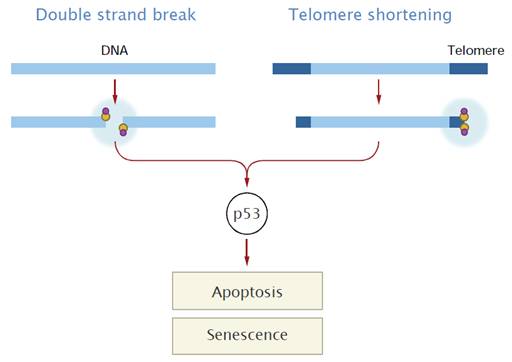
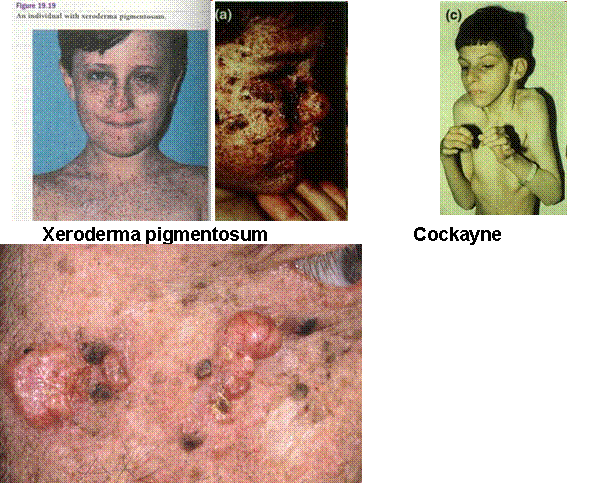
ATM (="ataxia telangiectasia mutated") - kettős DNS-törés érzékelése/jelzése - ezáltal a sejtciklus leállítása (p53-on keresztül) - normális telomerhossz fenntartása Cockayne
syndrome (Edward Alfred Cockayne
brit orvos után) Trichothiodystrophy
(kénhiányos haj, hámlás-zavar) Werner
syndrome – Progéria (WRN gén – helikáz mutációja, telomervesztés is
gyorsabb) Hereditary non
polyposis colon cancer (HNPCC) Xeroderma
pigmentosum (XP) (Nucleotide
excíziós repair, több fehérje) Bloom’s
syndrome Fanconi
Anaemia (Fanc... min. 13 gén
valamelyikének hibája) |
|
|
|
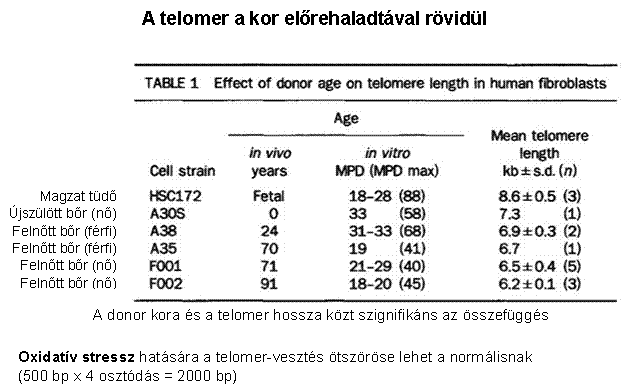
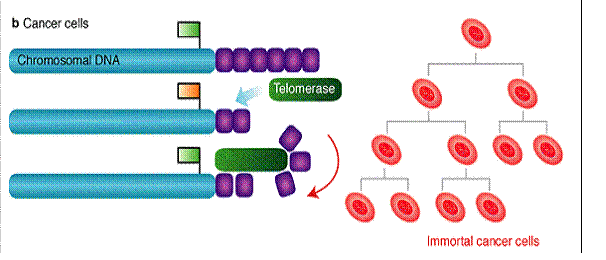
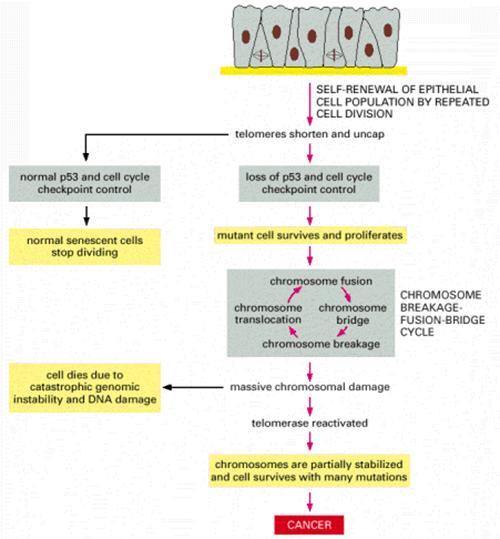
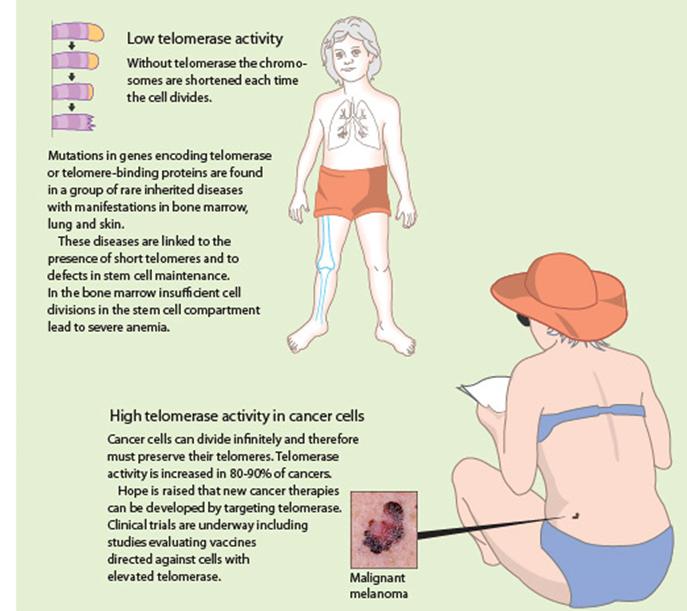
Telomerek és a
daganatkeletkezés a daganatsejtek korlátlan számú osztódásra
képesek vs. egy normális sejt 60-70 osztódásra
képes (Hayflick limit) (minden kromoszóma végéről minden
osztódás során egy szakasz 'elvész') a genetikailag nem stabil sejt
normális esetben elpusztul a daganatsejtek nem pusztulnak
el, tovább osztódnak és egyre több hibát halmoznak fel - képesek “halhatatlanná” tenni
magukat pl. a HeLa sejtvonal (Henrietta Lacks, 1951-ben izolálták) |
|
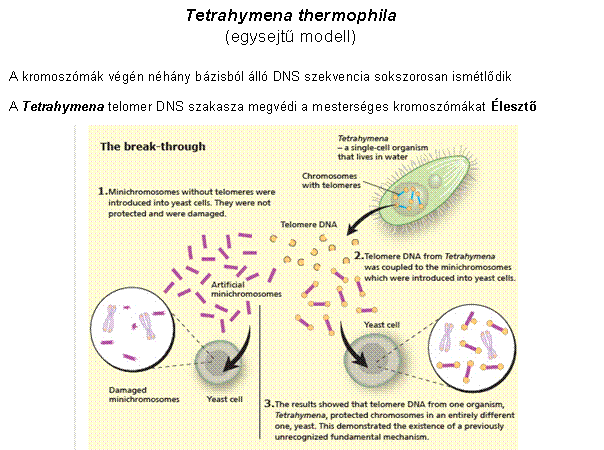
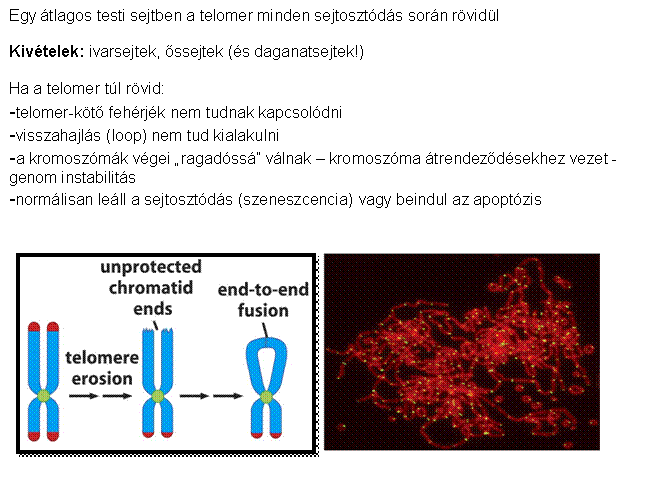
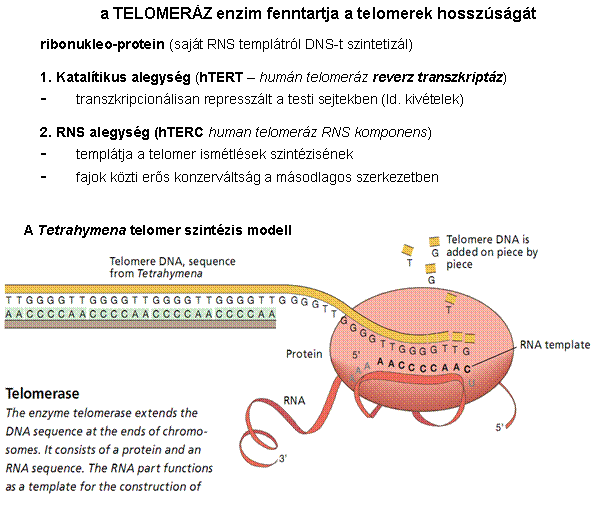
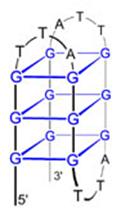
A kromoszómák végeit a telomerek védik, aminek
fenntartását a telomeráz enzim végzi
|
|
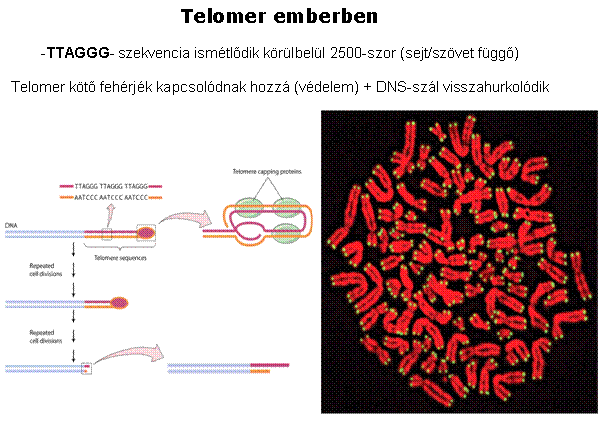
A telomer sapkaként védi a kromoszómák végeit Görög: telos (vég) + meros (rész)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
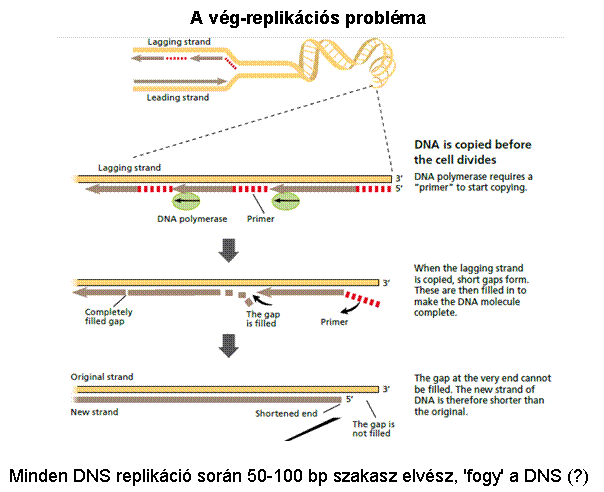
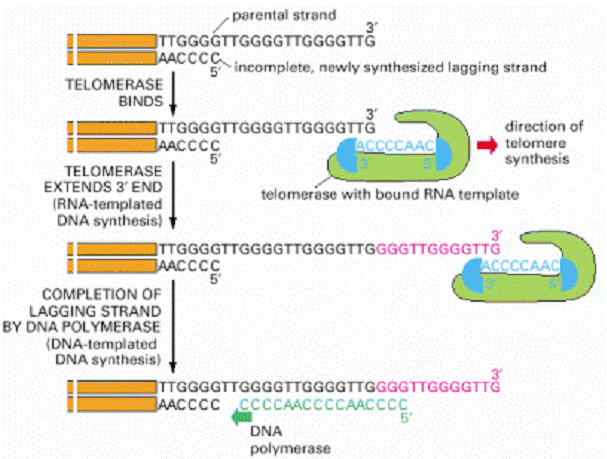
A telomer szintézisét a
TELOMERÁZ enzim végzi
|
|
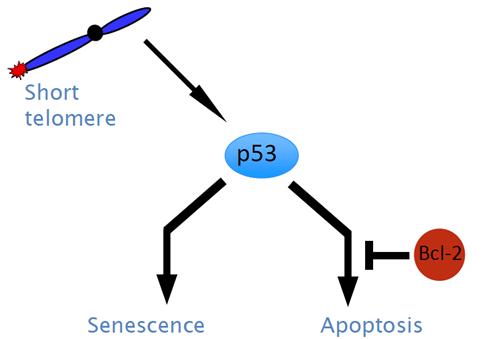
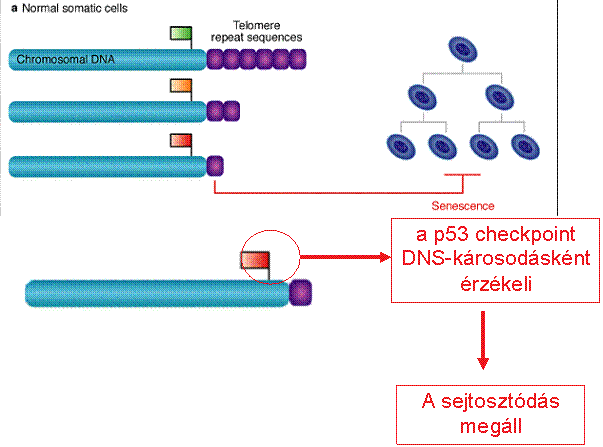
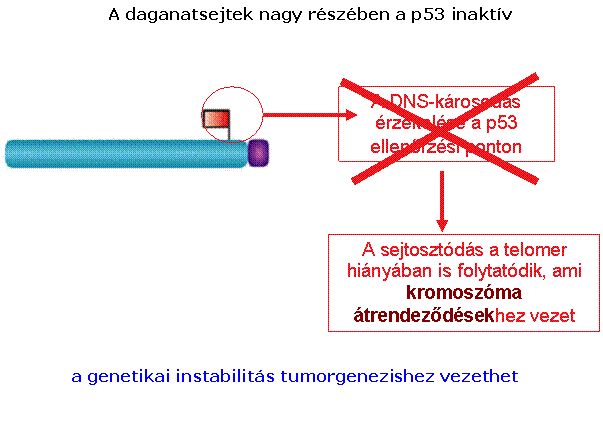
A szeneszcencia és apoptózis
védelmi szerepet tölt be a daganatképződés szempontjából
|
|
|
|
|
|
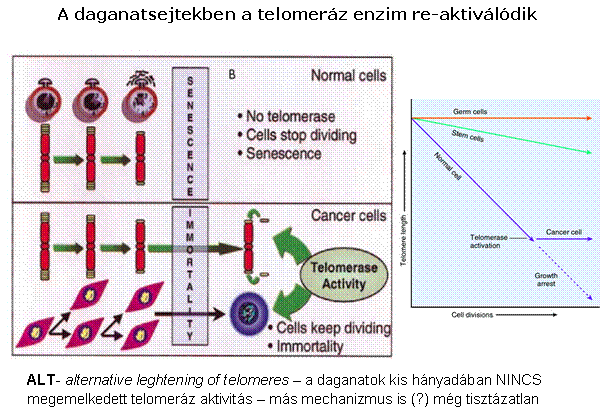
A telomeráz aktivitás a daganatsejtekben
fenntartja a telomerek hosszát, így az nem szab gátat a határtalan
sejtosztódásnak
|
|
|
|
Telomerek és dagatkialakulás
|
|
A telomereknek fontos szerepük van a rák, az
öregedés és néhány örökletes betegség kialakulásában
|
Daganatterápia telomeráz-gátlással?
szelektív, mert a normális szövetekben telomeráz-aktivitás
alig van
de!
hatásuk az őssejtekre (?!)
ALT-mechanizmus – „áttérve” erre a daganatsejtek
rezisztensekké válhatnak
monoterápiában nem használható